동행칼럼
물의 화학적 성질(1)
- 제목 :
- 물의 화학적 성질(1)
- 등록일시 :
- 2023-07-28
- 작성자 :
- 관리자
- 조회수 :
- 303

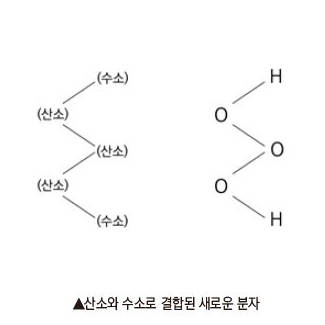
자연계 물의 화학적 구조는 주로 산소와 수소가 결합한 것으로 되어있다. 물과 같은 동족으로서의 여러가지 물질을 생각하여 볼 수 있다. 그러나 이들의 종류에는 두 가지가 존재한다. 그중의 하나가 과산화수소(H2O2)를 예로 들 수 있다. 이 외 한가지는 발견된지가 오래되지 않은 것으로서 분자의 구조를 열역학적 측면에서 조사·검토해보면 극저온의 상태에서는 '수소-산소-수소'나 '수소산소-산소-수소' 외에 '수소-산소-산소-산소-수소' 의 분자도 존재할 수 있는 것이 이론적으로 알려졌다.
수소와 산소가 이들 이상으로 결합하는 구조도 예측할 수 있다. 다시 말해서, '수소-산소-산소-산소-산소-수소'의 것도, 저온에서는 안정하게 존재할 수 있다는 생각이다. 이를 화학적 기호로 표기한다면 'H-O-H' 'H-O-O-H' 'H-O- O-O-H' 및 'H-O-0-0-0-H'로 표현된다. 여러 학자들이 이와 같은 구조의 실험적 연구에 돌입하여 'H-O-O-O-H 를 검토하고 있다. 이와같이 산소와 수소로 결합된 새로운 분자는 다음과 같이 지그재그의 형태로 원자끼리 결합한 형태로 추측되고 있고, 그 형태는 그림과 같다.
이 구조의 안정한 상태는 섭씨온도로써 0도보다도 낮은 온도에서만 존재 가능하고 이보다 온도가 높게 되면 분해된다. 저온 상태에서는 수소와 산소의 방전에 의하여 얻어 질 수도 있다. 그러므로 수소와 3산화물이 존재한다고 하는 이론적인 예측이 증명되었고 물 중에는 이와 같은 동일한 분자구조가 존재할 것으로 생각할 수도 있다. 물 분자의 전자구조에서 음성인 산소 원자와 양성인 수소 원자와의 결합으로써 두 극인 전기 쌍극자를 형성하게 된다. 이에 따라 쌍극자 모멘트를 가지게 된다. 그러므로 플러스와 마이너스의 극성은 다른 물질을 녹일 때 큰 위력을 발휘한다. 가령, 물속에 있는 이온성 물질을 분리하여 플러스 및 마이너스 이온으로 떨어뜨린다. 이때 이온화된 원자의 일부는 이온의 형태로 되고 반응성이 큰 상태가 된다.
물이 얼어서 산소와 수소 간의 결합이 세지고 거리가 가깝게 엉성한 고체 상태가 되면 체적은 증가하고 무게는 일정하여 체적과 무게가 동일한 액체의 물에 비하여 밀도가 감소하므로 얼음이 물에 뜨게 된다. 즉, 액체 상태인 물보다 얼음이 비중이 작아지는 이유이다. 빛깔도 맛도 냄새도 없는 물이 여러 물질에 작용하여 그들 물질의 특유한 빛, 냄새, 맛 등을 나타내주게 된다. 이 원인도 물이 특이한 수소와 산소의 결합에 의한 분자구조로 되어있기 때문이다.
1920~30년대에 포오링(pauling)을 위시하여 많은 연구자들에 의하여 원자가 주위의 많은 전자들로부터 그 전자를 잡아당기려는 능력 즉, 전기음성도의 개념이 체계화되었다. 물 분자 중의 산소와 수소는 전기음성도 차가 매우 커서 물분자끼리 잡아당겨 수소와 산소가 결합하게 된다. 따라서 물분자는 한쪽 분자의 수소와 다른 분자의 산소가 서로 세게 잡아당겨 화학결합이 이루어진다. 이를 수소결합이라고 한다.



